酵素の役割、反応速度
酵素はタンパク質の一種であり、生体での反応の触媒となる性質をもつ。また、酵素によって、反応がおこりやすくなる。
酵素の変性、失活
酵素は、熱や有機溶媒などによって、立体構造がくずれてしまう変性をおこし、反応をおこしやすくする触媒作用を失う。このことを失活という。
また、酵素の最適pHと最適温度は、それぞれの酵素ごとに異なっている。
酵素の単位、比活性
基質を1分あたり1マイクロモル(μmol)変化させる酵素の量を1単位という。一定のタンパク質重量か、一定の乾燥重量に対する単位数のことを、比活性という。
反応特異性
1つの酵素につき、1つの反応だけの触媒となることを反応特異性という。
基質特異性
1つの酵素が特定の基質だけに作用することを基質特異性という。
活性中心
酵素は、触媒作用をする部位である活性中心をもつ。活性中心と基質が結合することで触媒作用がおこる。それによって、基質が生成物へと変わる。そして、生成物が酵素から離れるという順番で酵素反応が行なわれる。
アイソザイム(イソ酵素)
酵素のうち、アミノ酸配列の順番が違うにもかかわらず、同じ反応を触媒する酵素が複数存在する場合がある。この場合、それぞれの酵素のことをアイソザイム(イソ酵素)という。
補酵素
特定の酵素が反応をおこすために必要とするものが補酵素である。補酵素は、対応する酵素の活性中心に結合することで、その酵素の作用に関わる。
・アポ酵素、ホロ酵素
補酵素が必要である酵素のうち、補酵素と結合していないタンパク質部分だけの酵素をアポ酵素という。逆に、補酵素と結合している酵素のことをホロ酵素という。
・補欠分子族
酵素タンパク質に共有結合している補酵素を補欠分子族という。また、補酵素は、そのほとんどがビタミンを含んだ状態で存在する。
酵素活性の調節
酵素の活性や酵素量の変化によって、酵素活性が調節される。
・酵素活性の変化
酵素の活性は、以下の場合に変化する。
・特定の化合物と酵素が共有結合したときと、その共有結合が解かれた場合
・生体内の成分と酵素が非共有結合したときと、その非共有結合が解かれた場合
・酵素量の変化
酵素量は、酵素の合成や分解の速度の調節によって変化する。
チモーゲン(酵素前駆体)
酵素には、不活性であるチモーゲン(酵素前駆体)として生成されるものがある。
例として、細胞の中で活性のあるペプシンやトリプシンが生成された場合、細胞内にあるタンパク質まで分解されることになる。それを避けるため、チモーゲンであるペプシノーゲンやトリプシノーゲンとして合成と分泌が行われる。そして、ペプシノーゲンとトリプシノーゲンは、消化管内で活性型へと変化する。
酵素の反応速度
酵素の反応速度は、基質濃度や温度、pHなどの条件が整っているときに、決まった時間内で一定の速さになる。そして一般的には、決まった時間内を過ぎることで、反応速度は低下していく。
また、基質濃度が十分なとき、反応速度は酵素量に比例して増加する。しかし、酵素量が多すぎてしまうと、酵素量に比例する速度の増加はおこらなくなる。
ミカエリス・メンテンの式
基質濃度を高めていくと、途中で反応速度の上昇がみられないところに達する。上昇がみられないところに達した反応速度を最大反応速度(記号:V)という。そして、最大反応速度の半分の速さを示す基質濃度をミカエリス定数(記号:Km)という。
※反応速度と基質濃度の関係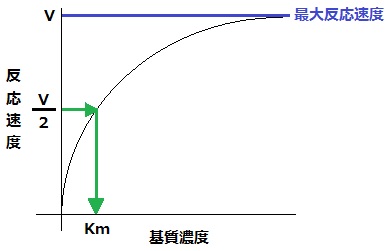
最大反応速度をV、ミカエリス定数をKm、基質濃度を[S]、反応速度をνとして、反応速度を求めるための式をつくると、
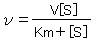 という形で表すことができる。この式をミカエリス・メンテンの式という。
という形で表すことができる。この式をミカエリス・メンテンの式という。
最大反応速度(V)とミカエリス定数(Km)は、それぞれの酵素で決まった値になっている。Kmの値が低ければ、その分低い基質濃度で反応する。そのため、Kmの値は、その酵素の反応がおこりやすいかを示す値となる。
ラインウィーバー・バーク二重逆数プロット法
最大反応速度(V)とミカエリス定数(Km)を求める方法の1つに、ラインウィーバー・バーク二重逆数プロット法がある。
この方法を用いる場合、ミカエリス・メンテンの式を逆数をとったかたちに変換する。すると、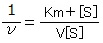 という式に変換できる。ここからさらに変換することで、
という式に変換できる。ここからさらに変換することで、
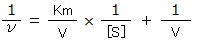 という式にできる。この式をラインウィーバー・バークの式という。
という式にできる。この式をラインウィーバー・バークの式という。
